Sản phẩm mới Avycaz là phối hợp kháng sinh đường tiêm tĩnh mạch mới được chấp thuận bởi FDA để điều trị nhiễm trùng có biến chứng.
FDA chấp thuận Avycaz để điều trị nhiễm trùng trong ổ bụng và nhiễm trùng đường tiểu. Avycaz có chứa cephalosporin thế hệ 3 là cetazidime và một chất ức chế β-lactamase mới là avibactam.
Hoa Kỳ là thị trường đầu tiên của Avycaz, được hy vọng sẽ xuất hiện vào quý 2 năm 2015. Một đơn xin cấp phép tới EMA cũng được gửi vào quý 1 năm 2015. Đây là kết quả từ sự hợp tác giữa AstraZeneca và Actavis. Actavis có quyền phân phối sản phẩm này ở Bắc Mỹ.
Sản phẩm được chấp thuận để điều trị ở người lớn bị nhiễm trùng trong ổ bụng có biến chứng (phối hợp với metronidazole) và nhiễm trùng tiểu có biến chứng bao gồm cả viêm nhu mô thận ở bệnh nhân hạn chế hoặc không có lựa chọn điều trị thay thế.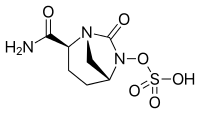 |
| Cấu trúc của chất ức chế β-lactamase mới avibactam |
Để giảm thiểu vi khuẩn đề kháng thuốc, nhãn của sản phẩm nhấn mạnh Avycaz chỉ nên sử dụng để điều trị nhiễm trùng được chứng minh hoặc khả năng cao gây ra bởi vi khuẩn nhạy cảm.
Chặng đầu tiên trong quá trình chấp thuận của FDA đối với Avycaz là việc chỉ định nó là một sản phẩn điều trị bệnh nhiễm đủ điều kiện, là những thuốc điều trị bệnh nhiễm nghiêm trọng hoặc đe họa tính mạng.
Nguyên nhân phổ biến nhất gây ra đề kháng đối với kháng sinh nhóm β-lactam, như ceftazidime, là sự thủy phân làm mất hoạt tính của vòng β-lactam bởi emzyme β-lactamase. Theo FDA, có hơn 1.400 β-lactamaes được xác định. Avibactam là chất ức chế β-lactam không β-lactam với hoạt tính kháng khuẩn yếu. Các chất ức chế β-lactam hiện có như acid clavulanic và tazobactam.
Cùng với việc bảo vệ Ceftazidime khỏi ESBL (β-lactamase phổ rộng), hãng Actavis cho biết avibactam có thể bảo vệ ceftazidime khỏi carpenemase của Klebsiella pneumoniae và các tác nhân tiết AmcP β-lactamase.
Liều khuyến cáo của sản phẩm là 2,5g (2g ceftazidime và 0,5g avibactam) mỗi 8 giờ theo đường tiêm truyền tĩnh mạch trong 2 giờ, đợt điều trị từ 5-14 ngày. Tác dụng phụ phổ biến bao gồm buồn nôn, nôn, táo bón, lo âu. FDA cho biết hiện tượng giảm hiệu quả, động kinh hay các biến cố thần kinh khác có thể thấy ở bệnh nhân suy giảm chức năng thận.
0 nhận xét:
Đăng nhận xét
Lưu ý: Chỉ thành viên của blog này mới được đăng nhận xét.